Química
5°4° y 5°5° Modalidad Ciencias Naturales
Profesora: Stoikoff, Stella
ACTIVIDAD 4 / SEMANA 4
Contenido a desarrollar: Estructuras de Lewis (Actividad 4)
Objetivo: que los alumnos
interpreten las estructuras de Lewis presentes en compuestos con enlaces covalentes.
Explicación sobre la
actividad a desarrollar:
En esta actividad trabajaremos con contenidos
dados en Química de 4to año. Es muy importante que se recuperen los saberes
previos referidos a estructuras de Lewis, electrones de valencia, regla del
octeto y enlaces covalentes, indispensables para poder comprender los próximos
contenidos a desarrollar.
Para ello les presento un
texto, con el fundamento teórico referido a los contenidos vinculados a
estructuras de Lewis, donde también hay ejemplos, con sus referencias, para que
todos los puedan visualizar.
La fuente que usé sobre
estructuras de Lewis y electrón de valencia es wikipedia.
Como opcional, pero
recomendado por mi, hay un video en youtube sobre enlaces covalentes, con el
cual van a terminar de comprender el tema.
Link
o video, texto de referencia:
FUNDAMENTO TEÓRICO
Un símbolo de Lewis es un símbolo en el cual los electrones de
la capa de valencia de un átomo son representados por puntos colocados
alrededor del símbolo del elemento. Cada punto representa un electrón.
La capa de valencia es la última capa de distribución de
electrones.
El número de electrones de valencia de un
elemento se puede determinar por el grupo de la tabla periódica de
elementos.
Grupo de la
Tabla periódica
|
Electrones de valencia
|
Grupo 1 (I)
(metales alcalinos)
|
1
|
Grupo 2 (II)
(metales alcalinotérreos)
|
2
|
Grupo 13 (III)
(grupo del boro)
|
3
|
Grupo 14 (IV)
(grupo del carbono)
|
4
|
Grupo 15 (V)
(grupo del nitrógeno)
|
5
|
Grupo 16 (VI)
(calcógenos)
|
6
|
Grupo 17 (VII)
(halógenos)
|
7
|
Grupo 18
(gases nobles)
|
8[i]
|
La estructura de Lewis muestra los diferentes átomos usando su símbolo
químico y líneas que se trazan entre los átomos que se unen entre sí. En
ocasiones, para representar cada enlace, se usan pares de puntos en vez de
líneas. Los electrones no enlazantes o par solitario de electrones (los que no
participan en los enlaces) se representan mediante una línea o con un par de
puntos, y deben colocarse siempre alrededor de los átomos a los que pertenece.
La teoría de Lewis se refiere principalmente al enlace covalente, el
cual se forma por compartición de electrones.
La regla del octeto, establece que los átomos se enlazan unos a
otros en el intento de completar su capa de valencia (última capa de la
configuración electrónica). La denominación “regla del octeto” surgió en razón
de la cantidad establecida de electrones para la estabilidad de un elemento, es
decir, el átomo queda estable cuando presenta en su capa de valencia 8
electrones (Configuración de gas noble).
Considerando que cada enlace covalente simple aporta dos electrones a
cada átomo de la unión, al dibujar un diagrama o estructura de Lewis, hay que
evitar asignar más de ocho electrones a cada átomo.
Excepción: El hidrógeno tiene un solo orbital en su capa de
valencia la cual puede aceptar como máximo dos electrones.
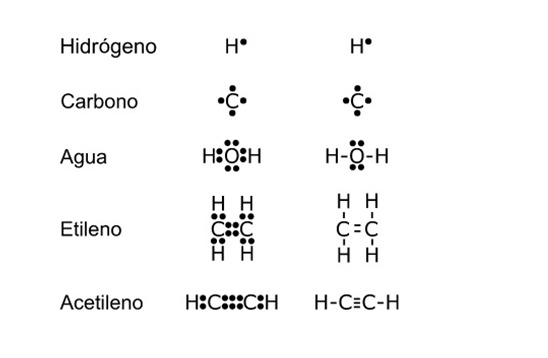
Ejemplo
del diagrama de puntos y diagrama de rayas entre carbono C, hidrógeno H, y
oxígeno O representados según la estructura de Lewis.[ii]
Actividad:
1-
Mencione dos características del enlace covalente.
2-
Represente la estructura de Lewis de:
a) El
átomo de oxígeno.
b) La
molécula de oxígeno.
3-Referido
a la consigna 2, responda:
a)
¿Cuántos electrones de valencia posee el átomo de oxígeno?
b)
Explique cómo usó la regla del octeto para representar la estructura de Lewis
de la molécula de oxígeno.
EVALUACION
EN PROCESO:
Estimados alumnos de química de quinto año modalidad naturales. A partir de
este trabajo les dejo un correo exclusivo para mis alumnos de quinto año
divisiones cuarta y quinta, para que cada semana me envíen sus trabajos.
Acuérdense que también se aprende a través del error. No tengan miedo a
equivocarse, traten de dar su mejor esfuerzo.
Nos conocemos y yo no dudo de sus
capacidades. Sigan mis consejos, para que puedan acreditar sus saberes.
Correo para entregar los trabajos de química:
quimica5naturales@gmail.com
OBSERVACIÓN:
Si
no pueden hacer las representaciones usando recursos informáticos, solicitadas
en el punto 2, no se preocupen. Lo
escriben en birome en una hoja, le sacan una foto y la insertan en el trabajo
en Word que me envían.
No hay comentarios.:
Publicar un comentario
Nota: sólo los miembros de este blog pueden publicar comentarios.